
根據(jù)《浙江省藥物臨床試驗(yàn)機(jī)構(gòu)監(jiān)督管理辦法(試行)》要求:“藥物臨床試驗(yàn)機(jī)構(gòu)應(yīng)將本機(jī)構(gòu)開(kāi)展的藥物臨床試驗(yàn)項(xiàng)目基本情況,、進(jìn)展情況及質(zhì)控情況等質(zhì)量管理信息等錄入省監(jiān)管平臺(tái),,并實(shí)行動(dòng)態(tài)更新和維護(hù)管理;相關(guān)信息發(fā)生變化時(shí),,應(yīng)在10個(gè)工作日內(nèi)在省監(jiān)管平臺(tái)中予以更新,;臨床試驗(yàn)項(xiàng)目的質(zhì)量管理總結(jié)報(bào)告應(yīng)在項(xiàng)目完成后的10個(gè)工作日內(nèi)錄入省監(jiān)管平臺(tái),。”
具體藥物臨床試驗(yàn)項(xiàng)目備案及更新信息流程如下:
一,、維護(hù)
1,、項(xiàng)目CRA負(fù)責(zé)在項(xiàng)目啟動(dòng)會(huì)召開(kāi)前,將以下資料提交至CTMS系統(tǒng):(1)臨床試驗(yàn)方案,;(2)知情同意書(shū),;(3)組長(zhǎng)單位倫理批件;(4)本中心倫理批件,;(5)臨床試驗(yàn)批件或臨床試驗(yàn)通知書(shū),。
*文件格式要求為Word或Pdf,每個(gè)文件大小不超過(guò)10M。
*首次備案應(yīng)在合同簽署完成后,。
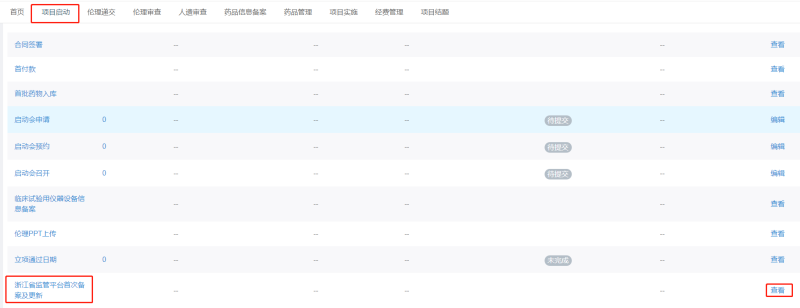
2,、平臺(tái)管理員負(fù)責(zé)完成備案,備案完成后將截圖反饋至項(xiàng)目CRA處,。
二,、變更
當(dāng)項(xiàng)目信息發(fā)生變化時(shí),如方案及知情同意書(shū)的修訂等,。
1,、項(xiàng)目CRA需在獲得倫理批件后5個(gè)工作日內(nèi),將相關(guān)資料(倫理批件,、修改的方案/知情同意書(shū)等)提交至CTMS系統(tǒng),。
*文件格式要求為Word或Pdf,每個(gè)文件大小不超過(guò)10M,。
2,、平臺(tái)管理員在5個(gè)工作日內(nèi)進(jìn)行更新,更新后將截圖反饋至項(xiàng)目CRA處,。