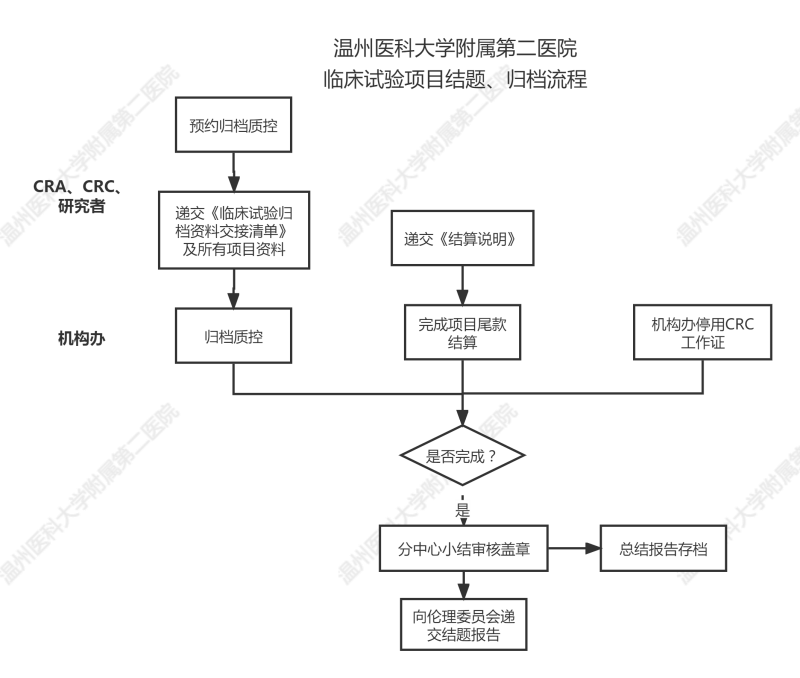
一、歸檔質(zhì)控
研究者確認(rèn)項(xiàng)目完成后,,按我院《臨床試驗(yàn)歸檔資料要求》遞交歸檔資料至機(jī)構(gòu)辦,。
機(jī)構(gòu)辦確認(rèn)資料齊全后,,在15天之內(nèi)完成質(zhì)控,。
說明:
(1)建議歸檔質(zhì)控時間:如為紙質(zhì)CRF,必須處理畢歸檔質(zhì)控問題后方可撕表,;如為EDC,,申請歸檔質(zhì)控時間應(yīng)在數(shù)據(jù)庫鎖庫前。
(2)如遇特殊情況,,質(zhì)控時間將可能會有所延長,,敬請見諒。
二,、財務(wù)結(jié)算:詳見《臨床試驗(yàn)財務(wù)中期/尾款結(jié)算及退款流程”》
三,、CRC工作證停用:機(jī)構(gòu)對CRC電子工作證進(jìn)行停用操作。
四,、向機(jī)構(gòu)辦申請結(jié)題
監(jiān)查員在確認(rèn)①歸檔質(zhì)控問題處理完畢(與質(zhì)控員溝通妥當(dāng));②尾款結(jié)算完畢,;③CRC證件已歸還后,,
可在CTMS系統(tǒng)上向機(jī)構(gòu)辦申請結(jié)題,要求上傳:1)財務(wù)結(jié)算說明(雙方蓋章版),;2)分中心小結(jié)(初稿),;
經(jīng)機(jī)構(gòu)辦審查通過后,可遞交紙質(zhì)分中心小結(jié)至機(jī)構(gòu)辦蓋章,,本中心按照分中心小結(jié)蓋章時間來計算結(jié)題/關(guān)中心時間,,不強(qiáng)制要求遞交關(guān)中心函。本分中心小結(jié)的模板不作強(qiáng)制要求,,本院模板僅供參考,。
*分中心小結(jié)完成蓋章后,,請配合倫理委員會完成項(xiàng)目結(jié)題審查。結(jié)題報告遞交流程見參考《臨床試驗(yàn)過程中文件遞交流程》
五,、總結(jié)報告審核蓋章,、存檔
項(xiàng)目統(tǒng)計完成后,需遞交總結(jié)報告至機(jī)構(gòu)辦及倫理委員會存檔,,遞交流程參考《臨床試驗(yàn)過程中文件遞交流程》,。
遞交總結(jié)報告要求必須為紙質(zhì),不接受刻盤,,組長單位及申辦方蓋章完整,。
附件
1、《臨床試驗(yàn)資料歸檔交接清單》----請至“醫(yī)院官網(wǎng)-科研教學(xué)-新藥研究-下載專區(qū)-《表格模板匯總》”下載
2,、《結(jié)題報告》----請于“醫(yī)院官網(wǎng)-科研教學(xué)-醫(yī)學(xué)倫理-《GCP機(jī)構(gòu)辦立項(xiàng)的研究項(xiàng)目倫理審查申請》”下載
3,、《分中心小結(jié)》---請至“醫(yī)院官網(wǎng)-科研教學(xué)-新藥研究-下載專區(qū)-《表格模板匯總》”下載