
一,、臨床試驗(yàn)主協(xié)議
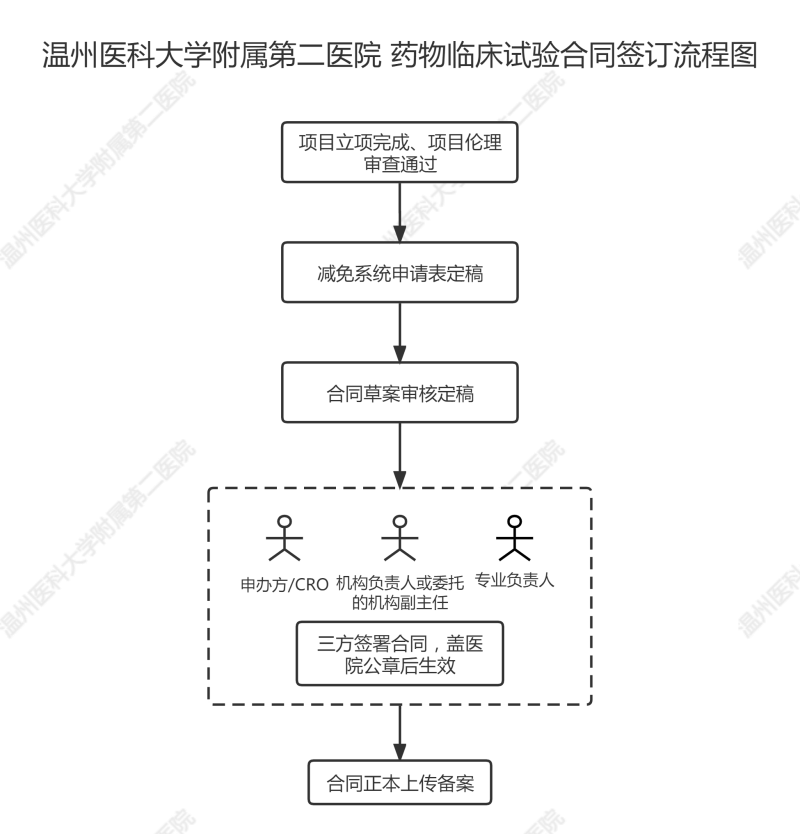
1,、CRA擬定合同前,,需先完成《臨床試驗(yàn)受試者費(fèi)用減免系統(tǒng)使用申請(qǐng)表》定稿,,根據(jù)協(xié)商結(jié)果制訂合同中相關(guān)檢查費(fèi),,流程見(jiàn)《“臨床試驗(yàn)受試者費(fèi)用減免系統(tǒng)”使用流程》。
*項(xiàng)目如不涉及減免項(xiàng)目,,可以直接上傳合同初稿,。
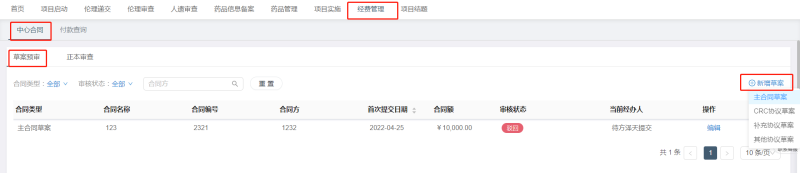
2,、減免申請(qǐng)表定稿后,CRA根據(jù)協(xié)商結(jié)果制訂合同中相關(guān)檢查費(fèi)并擬定合同,,再將合同草案及《臨床試驗(yàn)合同審核申請(qǐng)表》上傳至CTMS系統(tǒng)進(jìn)行審核,,審核流程為:CRA-PI-機(jī)構(gòu)辦財(cái)務(wù)管理人員-機(jī)構(gòu)辦質(zhì)控員-機(jī)構(gòu)辦主任-機(jī)構(gòu)辦財(cái)務(wù)管理人員(醫(yī)院法務(wù)),審核時(shí)間約1周左右,。
*合同簽署原則上采用我院臨床試驗(yàn)協(xié)議書(shū)模板,可按需提出修改意見(jiàn),。如必須使用申辦方/CRO模板,因涉及到醫(yī)院法務(wù)重新審核,,可能延長(zhǎng)合同審核及簽署時(shí)間,。
*請(qǐng)注意試驗(yàn)藥物如需在中心藥房管理,請(qǐng)?zhí)崆奥?lián)系機(jī)構(gòu)辦藥品管理員詢(xún)價(jià),,詳見(jiàn)《GCP中心藥房藥品管理要點(diǎn)及流程》,。
*請(qǐng)注意試驗(yàn)器械如需在DSA/手術(shù)室內(nèi)使用,必須由DSA/手術(shù)室護(hù)士進(jìn)行管理,,請(qǐng)?zhí)崆奥?lián)系手術(shù)室護(hù)士長(zhǎng)確認(rèn)工作量及詢(xún)價(jià),,詳見(jiàn)《手術(shù)室/DSA室器械管理申請(qǐng)流程》。
*請(qǐng)注意所有在龍灣院區(qū)和學(xué)院路院區(qū)涉及生物樣本處理的項(xiàng)目,,請(qǐng)?zhí)崆奥?lián)系GCP樣本庫(kù)樣本管理員詢(xún)價(jià),,詳見(jiàn)《GCP樣本庫(kù)管理要點(diǎn)及流程》
3,、合同審核通過(guò)后,請(qǐng)CRA將以下資料遞交至機(jī)構(gòu)辦公室,,簽署時(shí)長(zhǎng)約1周左右,,機(jī)構(gòu)辦李老師會(huì)每周在微信群內(nèi)更新簽署進(jìn)度。
(1)合同(公司方,、PI已完成簽署,,不接受法人章。如法人因故無(wú)法簽字,,可委托他人簽字,但需要提供委托函)
(2)《臨床試驗(yàn)受試者費(fèi)用減免系統(tǒng)使用申請(qǐng)表》
(3)本院倫理初審批件 或 CTMS中完成倫理審查截圖
注意:合同完成CTMS系統(tǒng)預(yù)審后,,1周內(nèi)必須提交紙質(zhì)文件。逾期審批將自動(dòng)作廢,,需要重新發(fā)起審批,。
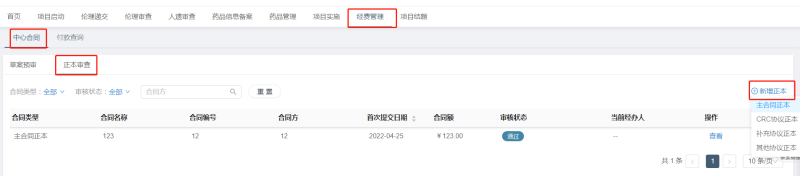
4、合同簽署完成后,,CRA上傳合同正本(簽字完成版本)至CTMS系統(tǒng)進(jìn)行備案。
*未完成合同正本審核將會(huì)影響后續(xù)入賬,。
5,、若需變更協(xié)議內(nèi)容,同上述流程,,采用我院模板《臨床試驗(yàn)修訂合同協(xié)議書(shū)》。
二,、《臨床研究護(hù)士合作協(xié)議》,、《臨床研究協(xié)調(diào)員(CRC)三方合作協(xié)議》
申辦方/CRO可根據(jù)實(shí)際需求,選用我院研究護(hù)士或第三方SMO公司的臨床研究協(xié)調(diào)員(CRC),,根據(jù)實(shí)際需求在試驗(yàn)啟動(dòng)前簽訂相應(yīng)的協(xié)議,。具體管理流程詳見(jiàn)《CRC入職、變更,、離職及管理流程》,。
*協(xié)議審核流程同主協(xié)議,先CTMS預(yù)審,,后遞交紙質(zhì),。
*簽署原則上采用我院臨床試驗(yàn)協(xié)議書(shū)模板,可按需提出修改意見(jiàn)
*三方協(xié)議上傳CTMS審核時(shí),,無(wú)需上傳《臨床試驗(yàn)合同審核申請(qǐng)表》,。《臨床試驗(yàn)合同審核申請(qǐng)表》上傳欄點(diǎn)開(kāi)“新文件”,選擇NA。
三,、電子簽章的使用
為加快臨床試驗(yàn)合同簽署流程,,我院可以使用電子簽章(包括法人章、合同章),。
要求申辦方/CRO在使用電子簽章時(shí),,應(yīng)符合《中華人民共和國(guó)電子簽名法》及相關(guān)法規(guī)的要求。
申辦方/CRO使用的電子簽章,應(yīng)確保:
1)已在公安部門(mén)平臺(tái)進(jìn)行備案,,且支持線上查詢(xún)備案情況,;
2)使用電子簽章的文件支持線上查驗(yàn),并能夠提供具體的查驗(yàn)方式,;
3)在提交草案審核時(shí),,同時(shí)上傳《電子簽章說(shuō)明文件》(必須使用醫(yī)院模板)。
附件材料-------請(qǐng)至“醫(yī)院官網(wǎng)-科研教學(xué)-新藥研究-下載專(zhuān)區(qū)-《表格模板匯總》”下載
1,、藥物臨床試驗(yàn)協(xié)議書(shū)
2,、器械臨床試驗(yàn)協(xié)議書(shū)
3、臨床研究護(hù)士合作協(xié)議
4,、臨床試驗(yàn)合同申請(qǐng)申請(qǐng)表
5,、臨床試驗(yàn)修訂合同協(xié)議書(shū)
6、臨床研究協(xié)調(diào)員(CRC)三方合作協(xié)議
7,、電子簽章說(shuō)明文件