
一,、啟動(dòng)前工作準(zhǔn)備
申辦方/CRO監(jiān)查員需按照《臨床試驗(yàn)啟動(dòng)申請(qǐng)》要求提前完成啟動(dòng)前相關(guān)準(zhǔn)備工作:
1、合同首筆研究經(jīng)費(fèi)到賬并開(kāi)具發(fā)票:流程見(jiàn)《臨床試驗(yàn)研究費(fèi)打款及開(kāi)具發(fā)票流程》,。
2、減免系統(tǒng)已完成維護(hù):流程見(jiàn)《“臨床試驗(yàn)受試者費(fèi)用減免系統(tǒng)”使用流程》,。
3,、試驗(yàn)物資已到位:包括各種記錄表、試驗(yàn)藥物/器械,、耗材等,。
注:針對(duì)需要通過(guò)受試者篩選/入組后觸發(fā)試驗(yàn)藥物/器械的項(xiàng)目,需要提供關(guān)于觸發(fā)機(jī)制的說(shuō)明文件及SOP,,告知具體的觸發(fā)流程及觸發(fā)后多久可以到位,,確認(rèn)受試者可以在方案要求的時(shí)間內(nèi)取藥,并且不會(huì)引發(fā)受試者額外的交通行程,。
4,、盲態(tài)/非盲CRA/CRC均已完成培訓(xùn)備案:流程見(jiàn)《CRC入職、變更,、離職及管理流程》,。
5、遺傳資源審批/備案工作程序已完成:流程見(jiàn)《人類遺傳資源管理相關(guān)辦事指南》,。
6,、按要求完成各平臺(tái)備案
(1)藥物臨床試驗(yàn)
根據(jù)浙江省局要求需完成浙江省監(jiān)管平臺(tái)信息備案:流程見(jiàn)《浙江省監(jiān)管平臺(tái)信息填報(bào)及更新流程》。
(2)醫(yī)療器械(含體外診斷試劑)臨床試驗(yàn)
根據(jù)《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》要求,,申辦者所在地省,、自治區(qū)、直轄市藥品監(jiān)督管理部門進(jìn)行臨床試驗(yàn)項(xiàng)目備案,。
(3)國(guó)家全民健康保障信息平臺(tái)醫(yī)學(xué)研究登記備案信息系統(tǒng)備案
根據(jù)國(guó)家衛(wèi)健委法規(guī),,要求我院承擔(dān)組長(zhǎng)單位的IIT項(xiàng)目和注冊(cè)類項(xiàng)目應(yīng)當(dāng)在國(guó)家全民健康保障信息平臺(tái)醫(yī)學(xué)研究登記備案信息系統(tǒng)(https://www.medicalresearch.org.cn/login)上完成信息登記,PI可聯(lián)系我院科研部陳建獲取填報(bào)賬號(hào),。要求格式如圖,。
7、臨床試驗(yàn)準(zhǔn)備階段資料遞交完整,、版本正確,。
8、已遞交《監(jiān)查計(jì)劃》(語(yǔ)言不限,,要求規(guī)定監(jiān)查頻率及監(jiān)查內(nèi)容,,公司蓋章紅章件或項(xiàng)目經(jīng)理簽字)。
9、科學(xué)性審查(僅限IIT項(xiàng)目)
請(qǐng)項(xiàng)目組邀請(qǐng)2名高級(jí)職稱專家對(duì)項(xiàng)目進(jìn)行科學(xué)性審查(模板見(jiàn)附件),,要求專家專業(yè)為研究所屬專業(yè)或研究方法學(xué)相關(guān)領(lǐng)取,,并將簽字版掃描件上傳至CTMS。
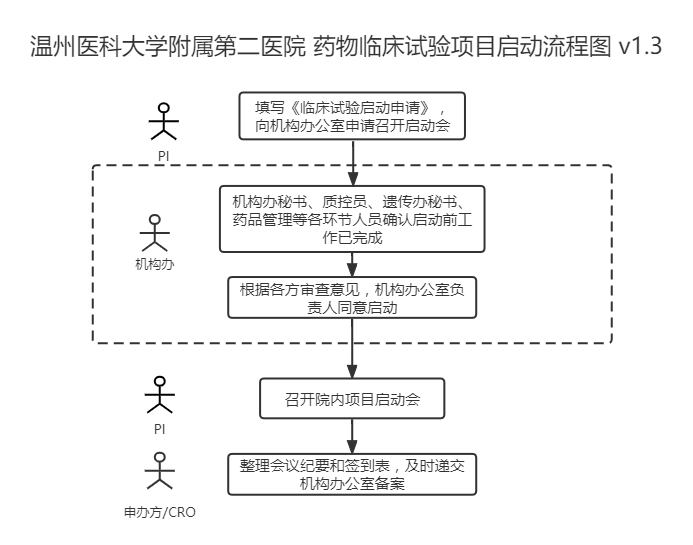
二,、遞交啟動(dòng)申請(qǐng)
請(qǐng)申辦方/CRO監(jiān)查員至少提前一周在“太美eSite臨床試驗(yàn)項(xiàng)目管理系統(tǒng)”上“啟動(dòng)會(huì)申請(qǐng)”中上傳關(guān)于前期準(zhǔn)備的證明文件,,經(jīng)PI、機(jī)構(gòu)辦質(zhì)控員及主任審核同意召開(kāi)啟動(dòng)會(huì),。
三,、召開(kāi)啟動(dòng)會(huì)
1、召開(kāi)時(shí)間和地點(diǎn)
由研究者團(tuán)隊(duì)自行商定在“太美eSite臨床試驗(yàn)項(xiàng)目管理系統(tǒng)”上“啟動(dòng)會(huì)預(yù)約”中填入具體的時(shí)間和地點(diǎn),,質(zhì)控員審批后安排時(shí)間參會(huì),。
2、啟動(dòng)會(huì)內(nèi)容
包括但不限于:介紹試驗(yàn)立項(xiàng)背景及試驗(yàn)的關(guān)鍵問(wèn)題,,講解試驗(yàn)方案,,講解質(zhì)量控制及質(zhì)量保證,問(wèn)題討論及答疑等,。
四,、會(huì)后要求CRA在“太美eSite臨床試驗(yàn)項(xiàng)目管理系統(tǒng)”上“啟動(dòng)會(huì)召開(kāi)”中上傳啟動(dòng)會(huì)會(huì)議紀(jì)要及簽到表,遞交機(jī)構(gòu)辦備案,。
附件----請(qǐng)至“醫(yī)院官網(wǎng)-科研教學(xué)-新藥研究-下載專區(qū)-《表格模板匯總》”下載
1,、《科學(xué)性審查備案表》